Die Bodenbeschaffenheit und der Boden-pH-Wert ist besonders wichtig für das gesunde Pflanzenwachstum, denn der pH-Wert hat einen großen Einfluß auf die Nährstoffverfügbarkeit und die Aktivität des Bodenlebens.
Liegt der pH-Wert im falschen Bereich, so kann es auch auf eigentlich nährstoffreichen Böden zu einer Nähstoffmangel und einer Wachstumsminderung der Pflanzen kommen.
Säuren bestehen immer aus positiv geladenen Kationen (Wasserstoff-Ionen H+) und negativ geladenen Anionen. Salze sind immer aus Kationen und Anionen zusammengesetzt.
Die Entstehung von Säuren ist Teil der natürlichen Bodenentwicklung. Bereits im Regenwasser sind organische Säuren wie die Kohlensäure enthalten.
Werden Säuren gebildet oder gelangen diese in den Boden, sorgt der Anstieg der Wasserstoffionen (H+) für eine Versauerung der Flächen und kann mit dem pH-Wert gemessen werden.
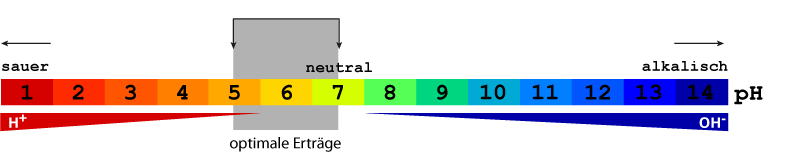
Der pH-Wert ist der negative dekadische Logarithmus der Wasserstoffionenkonzentration in der Bodenlösung. Auf einer Skala von 0 - 14 wird gemessen, wie stark eine wässrige Lösung sauer oder alkalisch/basisch ist. Werte von 0 bis ca. 6,5 sind saurer. Reines Wasser hat einen pH-Wert von 7 und gilt als neutral. Werte zwischen 7,5 - 14 sind alkalisch/basisch.
Die Messung des pH-Wertes erfolgt in einer Bodensuspension (Aufschlämmung) mit einer Messelektrode.
Der Optimalwert für die landwirtschaftliche Nutzung sollte je nach Kultur und Standort zwischen pH 5,5 und pH 7,5 liegen.
Bei der Bodenversauerung nimmt also die Konzentration der Wasserstoffionen (H+) im Bodenwasser zu und der Boden reagiert zunehmend sauer. Dieser Prozess entsteht sowohl durch natürliche, als auch durch vom Menschen gemachte Faktoren.
Betrachtet man die pH-Werte in der Landwirtschaft, bedeutet das:
pH 4 = H+- 10-4 mol/ l = 0,0001 g H+-Ionen/ l
Zunächst einmal ist die Versauerung ein ganz natürlicher Vorgang mit mehreren Ursachen:
Bei der Bodenatmung bildet sich bei der Zersetzung von Pflanzen und Mikroorganismen Kohlendioxid (CO2).
Kann das Kohlendioxid nicht aus dem Boden entweichen und kann z.B. durch verschlämmte Böden nicht in die Atmosphäre abgegeben werden, reagiert es zusammen mit dem Bodenwasser zu Kohlensäure (H2CO3).
CCO2 + H2O -> H2CO3 -> HCO3- + H+
Ist im Boden ausreichend Calciumcarbonat vorhanden, neutralisiert es die Kohlensäure, die in der Folge als Kalzium ausgewaschen wird.
Dieser Prozess geht solange gut, bis das Calciumcarbonat aufgebraucht ist, danach kommt es zu einer starken Versauerung der Böden und der pH-Wert fällt.
An Tonmineralien haftende Calciumverbindungen werden von sauren H+-Ionen verdrängt und ausgewaschen.


Im Zuge des Pflanzenwachstums wird dem Boden Kalk entzogen.
Durch die Nährstoffaufnahme werden fortlaufend saure H+-Ionen gegen gelöste Kationen wie Mg2+, K+ und Ca2+ ausgetauscht. Zur Wahrung der Elektroneutralität werden dafür saure H+-Ionen an den Boden abgegeben. Es bilden sich organische Säuren.
Der Verrottungsprozess von Tier- und Pflanzenresten würde Salze und Protonen wieder vereinigen und die entstandenen H+-Ionen neutralisieren.
Durch die Ernteabfuhr kommt es aber zu Basenentzug und in der Folge zu einer dauerhaften pH-Absenkung. Der Boden reagiert zunehmend sauer.
Ohne geeignete Gegenmaßnahmen wird die Nährstoffaufnahme in Folge gestört und das Pflanzenwachstum vermindert.
Bei der Wurzelatmung und bei der Mineralisation organischer Substanzen entsteht Kohlenstoffdioxid (CO2) und daraus große Mengen
an Kohlensäure.
Bei fehlendem Calciumcarbonat im Boden ist es nicht möglich das lösliche Calciumhydrogencarbonat (Ca(HCO3 )2) zu bilden und der
pH-Wert sinkt bis zu ca. 5 ab.
Ca(HCO3 )2 + 2 H+ → Ca++ + 2 CO2 + 2 H2O


Weitere natürliche Prozesse wie Niederschläge und Sickerwasser führen zu einer Auswaschung von basisch wirkenden Kationen und tragen ebenfalls zum Absinken des Boden-pH-Wertes bei.
Bei der Verbrennung fossiler Brennstoffe wie Kohle und Erdöl oxidiert der darin enthaltene Schwefel. Es entsteht kontaminierter Regen, der mit Schwefel- und
Salpetersäure verunreinigt ist. Der pH-Wert dieser Niederschläge liegt bei 3-4.
Mit dem Regen gelangen große Mengen an Wasserstoffionen (H+) in die Böden, die sich dort weiter konzentrieren und den Boden-pH-Wert stark absenken können.
In der Folge wird die Nährstoffaufnahme gehemmt und es entstehen Säureschäden und Wachstumshemmungen. Auch die Bodenorganismen leiden unter der Versauerung.
Eine neuere Herausforderung stellen verstärkte Niederschläge in Folge des Klimawandels dar, die zu einer massiven Auswaschung der basischen Kationen wie
Magnesium, Kalium und Calcium führen.

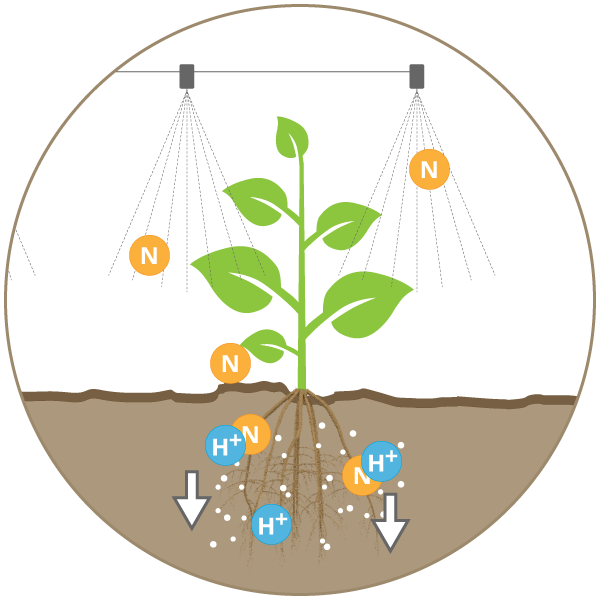
Die Mineraldüngung hat sich von der Verwendung kalkhaltiger Dünger mit ihrer positiven Auswirkung auf die Kalkzustände der Böden zur fast auschließlichen Verwendung von schwefelhaltiger Stickstoffdünger (z.B. SSA, ASS) entwickelt. Diese sauer wirkenden Düngemittel führen besonders auf kalkarmen Böden zu einer Versauerung der Flächen.